
沈阳海诺威医药科技有限公司
Shenyang Hinewy Pharmaceutical Technology Co., Ltd.
Shenyang Hinewy Pharmaceutical Technology Co., Ltd.
溃疡性结肠炎治疗药物托法替尼结肠靶向前药HNW-002及结肠靶向药物递送系统5-ASA-PABA-Diamine
一、溃疡性结肠炎及其流行病学和产生机制
溃疡性结肠炎(ulcerative colitis,UC)是一种以黏液性血便、腹部疼痛、腹泻为主要临床表现的慢性复发性疾病,主要特征为直肠及结肠的浅表黏膜层溃疡,常伴有关节、皮肤、眼部、肝胆等部位不同程度的损害,如关节炎、原发性硬化性胆管炎、坏疽性脓皮病和静脉血栓栓塞等。随着病情的发展,甚至有癌变可能。一项荟萃分析发现,UC患者结肠癌的发病率随病程延长而逐年增加,患者10年、20年、30年后患结肠癌的概率依次为1.6%、8.3%、18.4%。本病好发于45-59岁人群,且无性别差异。近年来,随着社会经济的不断发展,我国UC发病率显著上升(11.60/10000)。UC的病因较为复杂,目前尚不明确,临床报道其与遗传、饮食、免疫等因素相关。由于UC病情反复发作、迁延不愈,且具有癌变倾向并伴随多种肠外症状,所以WHO将其确定为现代难治病之一。
目前,UC的治疗主要在于控制疾病活动和维持缓解。随着人们对 UC认识的加深,各种治疗手段也变得丰富,传统的治疗药物包括5-氨基水杨酸制剂和糖皮质激素,免疫抑制剂如硫唑嘌呤、6-巯基嘌呤、甲氨蝶呤、环孢素A等,但临床上仍有一部分患者因疗效不佳或不良反应太大而停药。因此,临床迫切需要新的安全有效的UC治疗药物。
众多学者认为,UC的发生是由于多种炎症细胞因子过度表达,导致JAK/STAT信号通路被不同程度地激活,进而导致肠黏膜中抗炎因子的水平下降,促炎因子的水平升高,引起免疫失衡。UC中释放的细胞因子与UC的发展及其并发症密切相关,几乎所有细胞因子均使用 JAK/STAT信号通路作为共同的信号通路,JAK抑制剂可以同时阻断多种细胞因子的活性,从而有效治疗UC。
二、溃疡性结肠炎治疗药物托法替尼
托法替尼是一种小分子JAK激酶抑制剂,由美国辉瑞制药公司研究开发。2012年美国食品及药物管理局批准用于治疗对甲氨蝶呤不耐受的中重度类风湿性关节炎,2018年批准用于抗TNF治疗失败或常规药物无效的中重度UC。
美国辉瑞公司对托法替尼治疗UC进行了三期多中心、随机、双盲、安慰剂对照试验。将临床缓解率作为主要观察指标,黏膜愈合程度作为次要观察指标。在一期试验中,614例患者中122例患者接受安慰剂,476例患者接受10mg bid剂量的托法替尼。10mg托法替尼组和安慰剂组患者的8周缓解率分别是15.8%和8.2%。10mg托法替尼组的黏膜愈合率明显高于安慰剂组。10mg托法替尼组对于部分Mayo评分相对于基线的改善明显大于安慰剂组。在二期试验中,547 例患者中112例患者接受安慰剂,429例患者接受10mg bid剂量的托法替尼,数据得出10mg托法替尼组和安慰剂组患者的周缓解率分别是 16.6%和 3.6%。而在两期试验中,经过托法替尼8周治疗,C反应蛋白在第4周开始下降。结果表明,在接受托法替尼10mg bid治疗8周后的临床缓解率、黏膜愈合率和临床反应率明显高于安慰剂组,给患者的生活质量带来了很大改善。而在第三期维持试验中,对 598例患者进行双盲、安慰剂分组,评估他们52周的临床缓解率及黏膜愈合率,可以看到无论是托法替尼治疗组任一剂量,其主要临床缓解率及黏膜愈合率均高于安慰剂组。
在伊朗进行了一项为期52周的前瞻性临床试验,研究共纳入了 53 名患者。结果显示,所有患者基于 Mayo总评分和部分 Mayo 评分的临床缓解率在治疗 52 周时分别为 61.1% 和 72.2%。在另一项前瞻性研究纳入了曾使用过肿瘤坏死因子α拮抗剂和维多珠单抗的难治性活动期UC患者。结果显示,接受托法替尼治疗的患者有1/3在第14周达到临床缓解(不再使用皮质类固醇治疗);70%的患者在 1年内避免了结肠切除术。一项在荷兰 15 家医院进行的前瞻性临床试验中也得出了相似的结论,表明托法替尼是肿瘤坏死因子α拮抗剂和维多珠单抗失败后治疗 UC 的有效方法。然而,该研究观察到的托法替尼的不良事件发生率较高,最终导致6% 的患者停药。此外,另一项纳入了既往经英夫利昔单抗、环孢素治疗失败的 55名难治性重度UC患者开展试验,结果证明因难治性重度 UC 发作而住院的患者在使用托法替尼后6个月内未行结肠切除术的生存率为 73.6%,第 6 周临床缓解率和不再使用激素治疗的患者比例分别为 60.0% 和 37.5%。
UC具有慢性、复发性特点,给患者及社会带来了沉重的负担。JAK-STAT通路是UC发病的关键信号通路,托法替尼可作用于该通路治疗UC。托法替尼与生物制剂相比成本更低。2017年托法替尼于我国上市,被批准用于治疗难治性皮肌炎、类风湿性关节炎等,暂无UC的适应证,目前国内也尚未见托法替尼治疗 UC 的临床研究。国外研究表明,托法替尼的使用可以极大地改善患者症状,减轻疾病痛苦,改善黏膜愈合,提高患者生存质量。尤其是针对难治性重度UC患者,该药可降低UC患者行结肠切除术的几率或延迟切除时间,可以作为治疗中重度UC一线治疗药物。
三、托法替尼的剂量限制性毒性
研究表明,托法替尼是泛JAK受体抑制剂,高剂量的托法替尼可影响多个JAK 受体,可能导致血液学、代谢或免疫方面的不良反应。美国FDA指出,使用托法替尼可能增加严重感染、死亡、恶性肿瘤、重大不良心血管事件和血栓形成风险。EMA建议,高剂量托法替尼不得应用于肺栓塞风险增加的患者。一项纳入了 260 名 UC 患者的真实世界研究显示,患者不良反应发生率为15.7%,严重不良反应发生率为10.0%。目前,托法替尼治疗UC最常见的严重不良反应是严重感染,尤其是带状疱疹感染。托法替尼在治疗类风湿性关节炎和银屑病关节炎时已被证明会增加带状疱疹的风险。Sandborn等研究了托法替尼剂量与带状疱疹感染的关系。结果显示,服用托法替尼10mg(每日 2 次)的患者带状疱疹感染的风险大于服用5mg(每日2次)的患者,即托法替尼剂量的增加可能会增加带状疱疹发病的风险。因此,为降低带状疱疹发生率,在 UC 的维持治疗期应考虑采用托法替尼最低有效剂量进行治疗。因此,托法替尼存在剂量限制性毒性。
四、基于5-ASA-PABA-Diamine结肠靶向药物递送系统设计的托法替尼前药HNW-002
为解决托法替尼的剂量限制性毒性,提高其治疗溃疡性结肠炎的安全性和疗效,我们设计了口服结肠靶向给药系统5-ASA-PABA-Diamine,并基于该系统设计了托法替尼结肠靶向前药HNW-002。该系统可以利用结肠部位的肠道菌群产生的偶氮还原酶,将所负载的托法替尼在结肠部位特异性地释放,从而实现其结肠靶向给药。
1、HNW-002的胃肠道稳定性试验
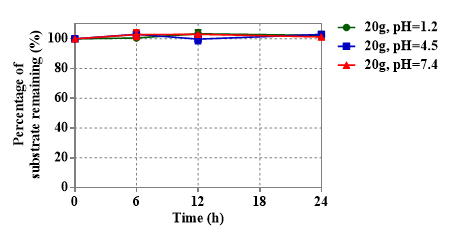
Figure 1. Stability of colon-targeted prodrug 20g (HNW-002) against the variable pH buffers. (A) pH = 1.2; (B) pH = 4.5; (C) pH = 7.4. Each value is the mean ± SEM; n = 3.

Figure 2. Stability profiles of colon-targeted prodrug 20g (HNW-002) in simulated gastric (A) and intestinal fluid (B). Each value is the mean ± SEM; n = 3.
HNW-002在体外不同的pH缓冲液和人工胃肠液中均较稳定,该试验结果表明HNW-002在胃肠道中具有较高的稳定性。
2、HNW-002的体外和体内释放行为试验
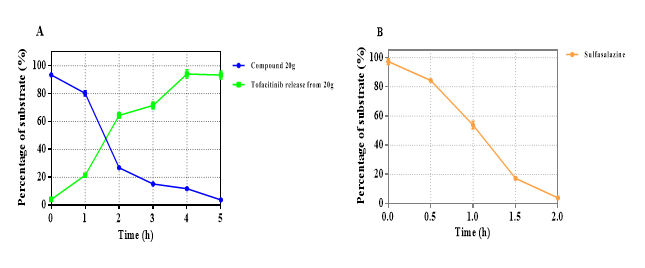
Figure 3. Release study of colon-targeted prodrugs by reduction of azo reductase in colon content. (A) 20g; (B) Sulfasalazine. Each value is the mean ± SEM; n = 3.
HNW-002在体外采用结肠内容物进行孵育,在4h内能够成功释放出母药托法替尼。
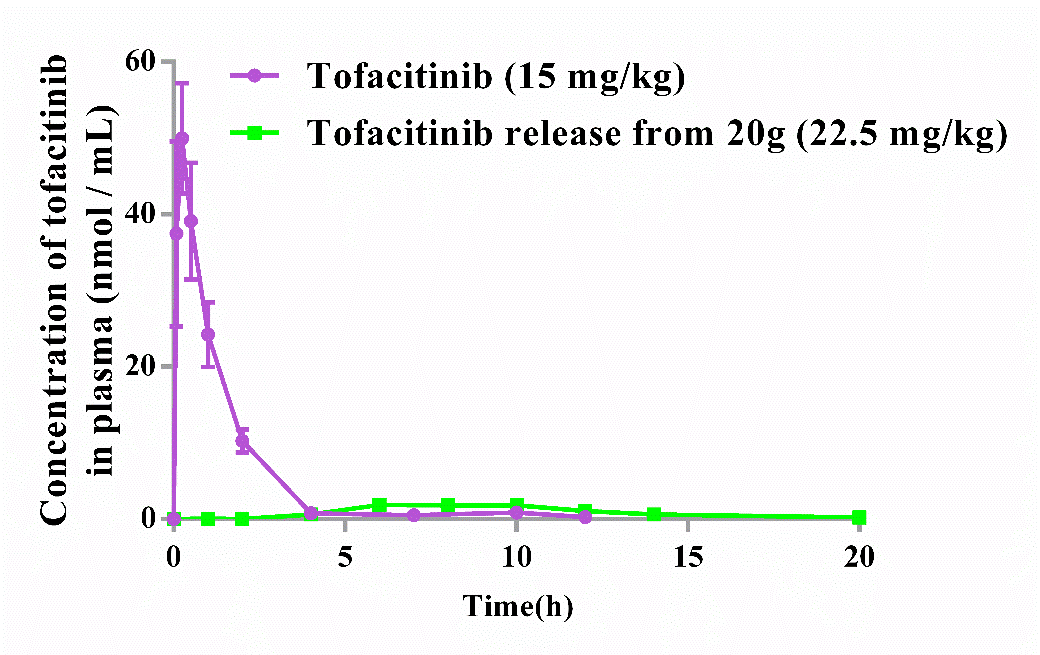
Figure 4. Concentration−time curve of tofacitinib obtained following oral administration of 15 mg/kg tofacitinib citrate and 22.5 mg/kg compound 20g (at an equivalent dose of 15 mg/kg tofacitinib citrate).
Table 1. Main PK parameters of compounds 20g and tofacitinib citrate in SD rats after administration (n = 6).
|
Parameters |
20g (22.5 mg/kg) |
Tofacitinib citrate (15 mg/kg) |
|
Cmax (nmol/mL) |
2.49 ± 0.52 |
54.87 ± 11.82 |
|
Tmax (h) |
8.00 ± 1.79 |
0.42 ± 0.30 |
|
AUC(tofacitinib,0-∞) (nmol·h/mL) |
19.27 ± 2.85 |
70.66 ± 7.28 |
|
t1/2 (h) |
3.09 ± 2.05 |
3.94 ± 2.60 |
体内实验表明,与托法替尼相比,HNW-002具有更低的系统暴露量。
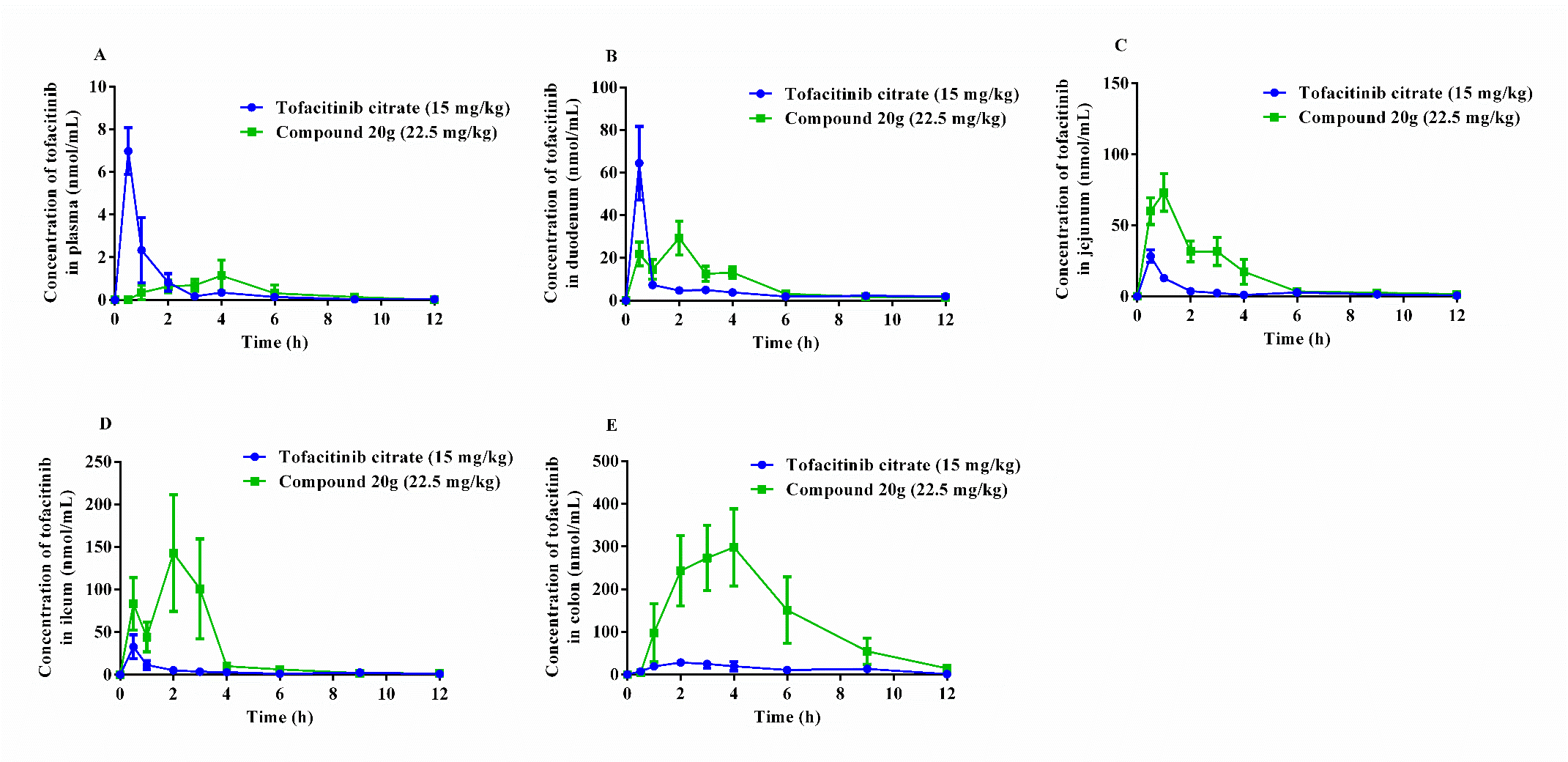
Figure 5. Tissue distribution of tofacitinib after oral administration of tofacitinib citrate (15 mg/kg) or compound 20g (2.5 mg/kg) from 0 h to 12 h (mean ± SEM, n = 6).
Table 2. AUC(tofacitinib, 0-12h) values of the tissue distribution of tofacitinib after the oral administration of tofacitinib citrate and compound 20g (n = 6).
|
Tissue (nmol/mL·h, mean ± SD) |
Tofacitinib citrate (15 mg/kg) |
20g (22.5 mg/kg) a |
|
Plasma |
7.1 ± 0.8 |
4.5 ± 0.5 |
|
Duodenum |
67.0 ± 21.7 |
99.0 ± 26.3 |
|
Jejunum |
43.0 ± 7.5 |
193.2 ± 39.3*** |
|
Ileum |
50.3 ± 26.0 |
357.1± 132.4*** |
|
Colon |
166.7 ± 51.5 |
1601.9 ± 259.2*** |
a ***P < 0.001 vs tofacitinib
与托法替尼相比,HNW-002具有更高的肠组织分布。其中,在结肠组织分布中,HNW-002的AUC(tofacitinib, 0-12h) 为托法替尼的9.6倍。
该结果表明HNW-002成功实现了托法替尼结肠靶向给药,证明了5-ASA-PABA-Diamine结肠靶向释放系统的可行性。
3、HNW-002的体内药效学试验
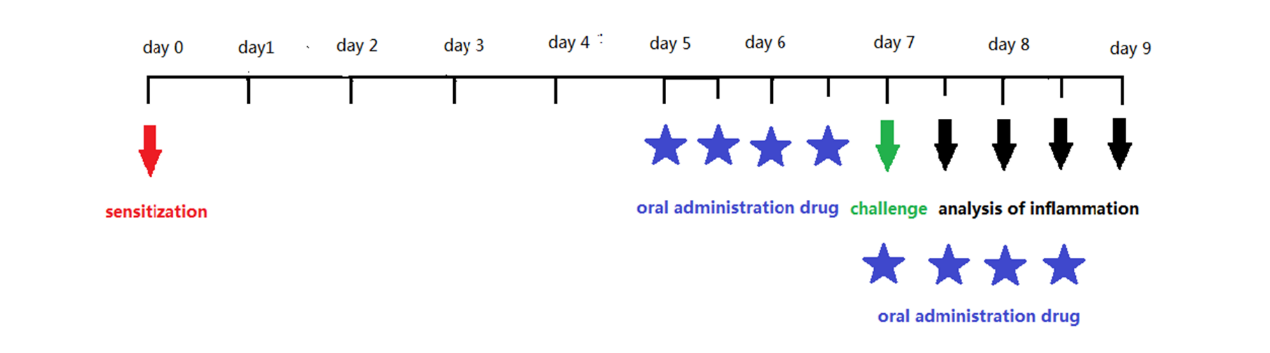
Figure 6. Time scheme for acute oxazolone colitis model.
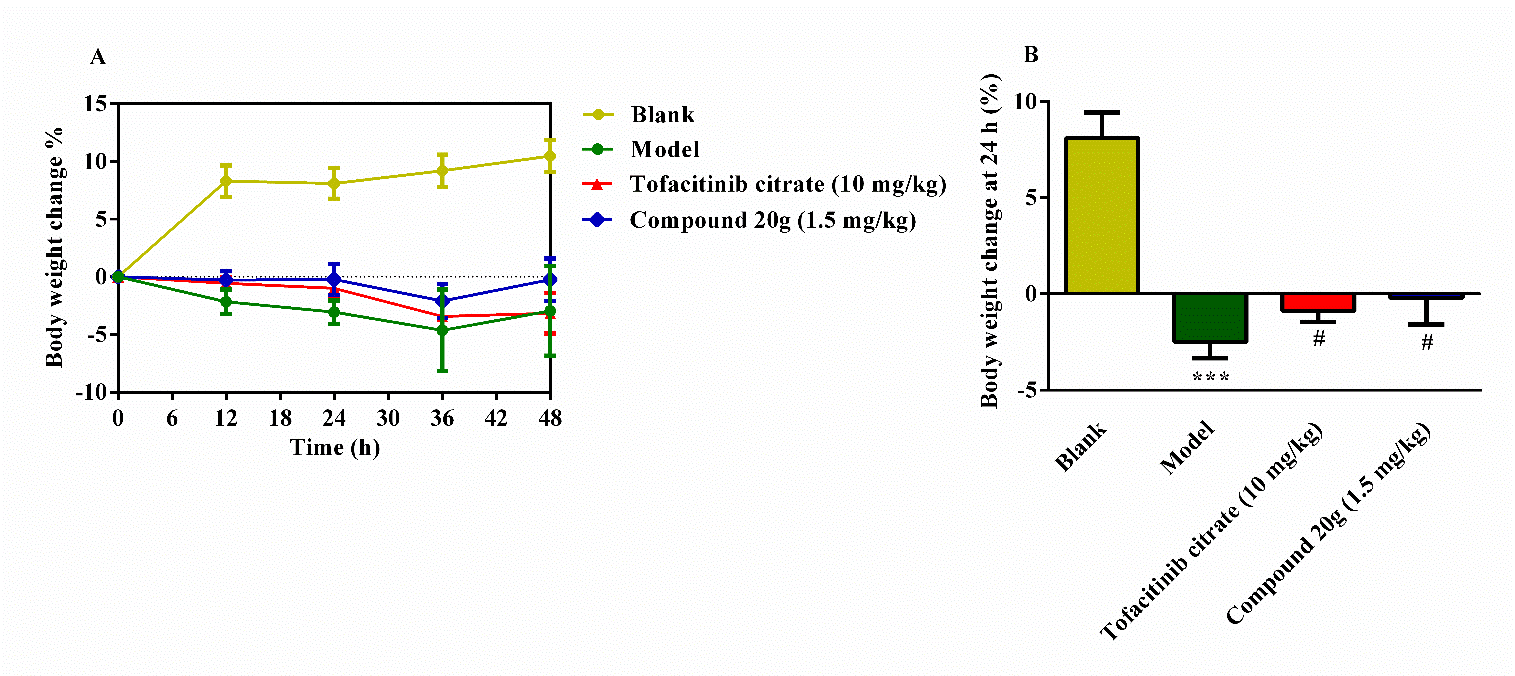
Figure 7. Efficacy of compound 20g (1.5 mg/kg) and tofacitinib (10 mg/kg) in oxazolone-induced colitis model. (A) Time–response curve of body weight loss. (B) Body weight change at 24 h.

Figure 8. Pathological responses at 36 h in oxazolone-induced colitis in mice. (A) DAI at 36 h. (B) Body weight change score at 36 h. (C) Stool consistency score at 36 h. (D) Bloody stool score following oxazolone challenge to presensitized mice at 36 h. Data are expressed as mean ± SEM (n = 7–9). *P < 0.05, **P < 0.01, and ***P < 0.001 vs blank (Student’s t-test). #P < 0.05 and ##P < 0.01 vs model (one-way ANOVA, Fisher’s LSD post hoc test); ՓP < 0.05 for compound 20g vs tofacitinib (one-way ANOVA, Fisher’s LSD post hoc test).
疾病活性指数评价表明,HNW-002以托法替尼的十分之一的口服剂量实现了相近的治疗效果。

Figure 9. Pathological responses of the colon and spleen at 36 h in oxazolone-induced colitis in mice. (A) Colon density. (B) Colon weight. (C) Colon length; colon density = colon weight/colon length. (D) Spleen index; spleen index (mg/g) = spleen weight (mg)/animal body weight (g). Data are expressed as mean ± SEM (n = 7–9). *P < 0.05, **P < 0.01, and ***P < 0.001 vs blank (Student’s t-test). #P < 0.05 and ##P < 0.01 vs model (one-way ANOVA, Fisher’s LSD post hoc test).
结肠的生理指标评价表明,HNW-002以十分之一的口服剂量对结肠炎的改善效果与托法替尼相近。
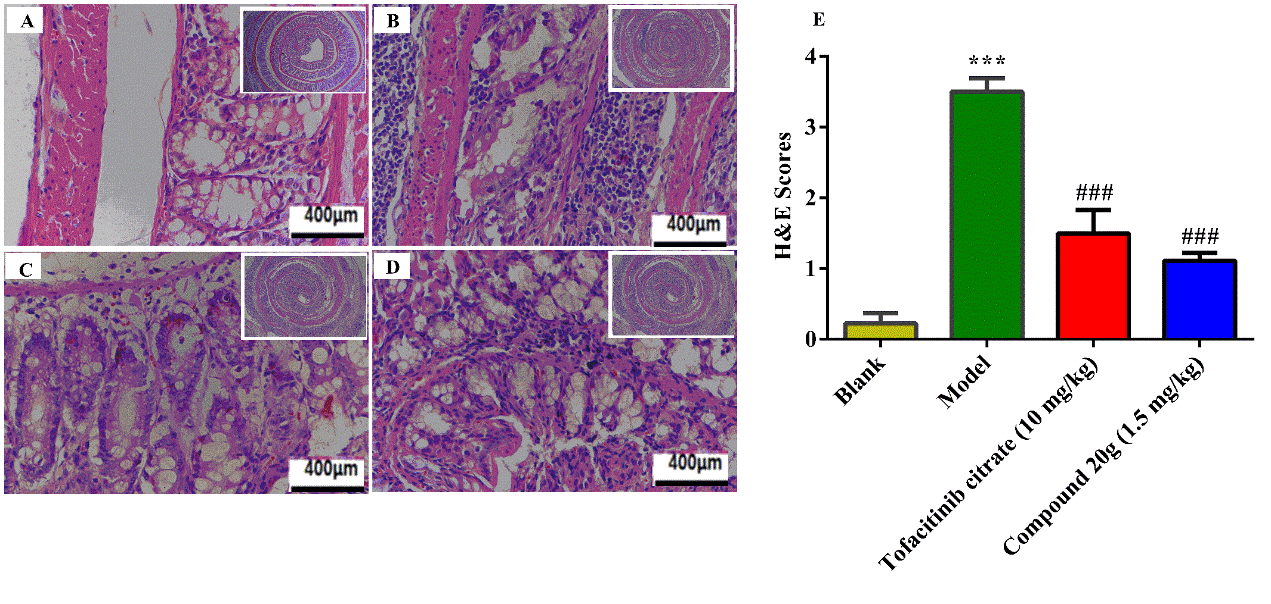
Figure 10. Histological analysis of the effects of orally dosed tofacitinib citrate (10 mg/kg) and compound 20g (1.5 mg/kg) on colon tissue following oxazolone challenge to presensitized mice. (A) Representative image of the blank group. (B) Representative image of the model group. (C) Representative image of the 10 mg/kg tofacitinib group. (D) Representative image of the 1.5 mg/kg compound 20g group. (E) Histological scores according to the histological grading criteria (inflammation: 0 none, 1 slight, 2 moderate; edema: 0 none, 1 slight, 2 moderate). Data are expressed as mean ± SEM (n = 7–9). ***P < 0.001 vs blank (Student’s t-test), ###P < 0.001 vs model (one-way ANOVA, Fisher’s LSD post hoc test).
结肠的组织切片分析表明,HNW-002以十分之一的口服剂量对结肠炎的治疗效果与托法替尼相近。
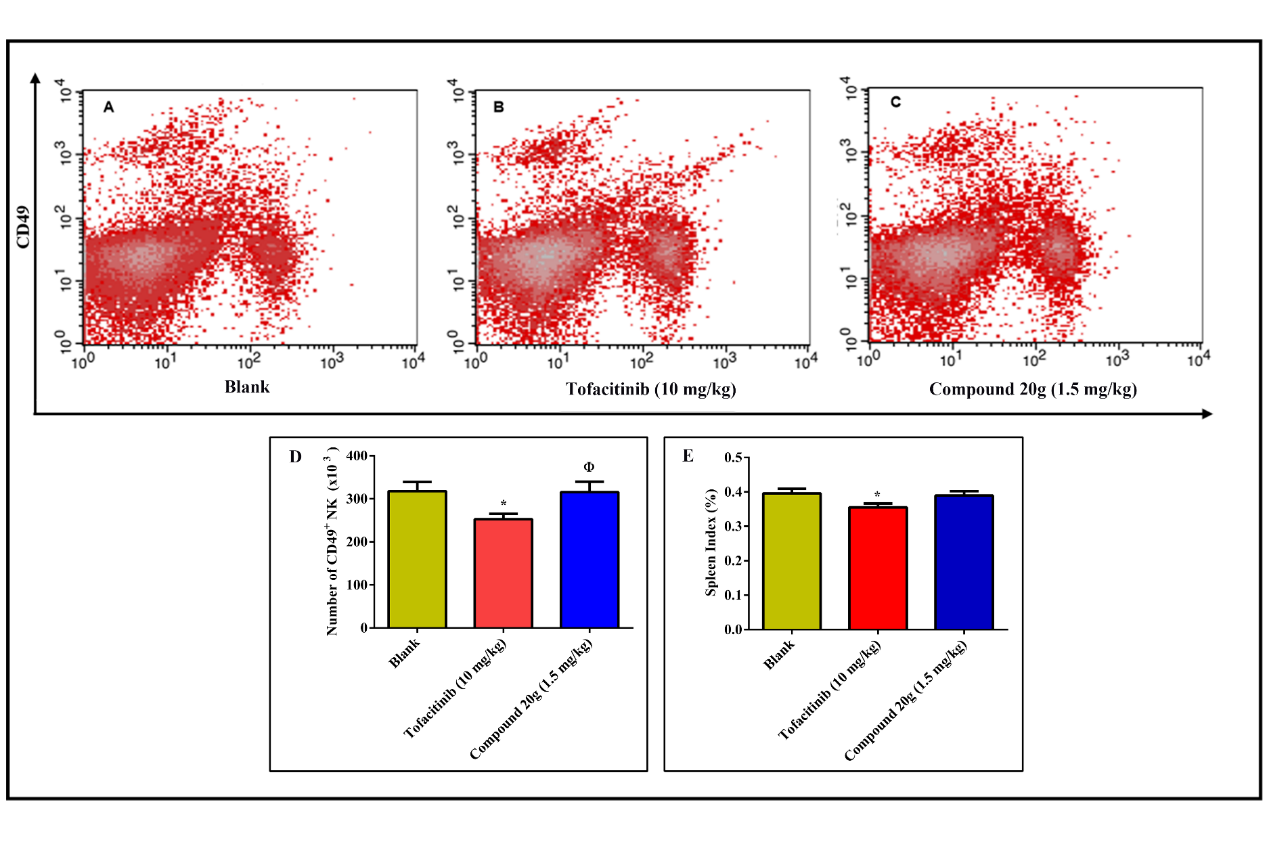
Figure 11. Effects of orally dosed tofacitinib citrate (10 mg/kg) and compound 20g (1.5 mg/kg) on the spleen index and absolute splenic CD49+ NK cell counts. (A) Representative flow cytometry plots of splenic lymphocytes of the blank group. (B) Representative flow cytometry plots of splenic lymphocytes of the tofacitinib citrate group (10 mg/kg). (C) Representative flow cytometry plots of splenic lymphocytes of the compound 20g group (1.5 mg/kg) . (D) Effect of compound 20g and tofacitinib citrate on absolute splenic CD49+ NK cell counts. (E) Effect of compound 20g and tofacitinib on the spleen index.
根据文献报道,托法替尼可剂量依赖性降低脾脏指数和脾脏 CD49 + NK 细胞的绝对数量,而这两项免疫参数的改变,将增加患者感染的风险。因此,我们通过测定脾脏 CD49 + NK 细胞的绝对数量和脾脏指数来评价化合物HNW-002的系统性免疫抑制力。如 Fig.11 所示,与空白组相比,口服10 mg/kg 的枸橼酸托法替尼,可使脾脏 CD49+ NK 细胞的绝对数量降低20.5%,脾脏指数降低10.3%。而口服生物学等效剂量(1.5 mg/kg)的化合物HNW-002,未能引发脾脏 CD49+NK 细胞的绝对数量和脾脏指数的改变。这一研究结果说明通过结肠靶向的策略,HNW-002不仅提高了原型药托法替尼的治疗效果,同时还降低了其系统性的免疫抑制。
为了评价HNW-002的急性毒性,取雌雄各半的小鼠,将其随机分为HNW-002组和空白对照组。经单次口服给予实验组小鼠2000 mg/kg的化合物HNW-002,而空白对照组给予相同体积的CMC-Na溶液。观察并记录给药后24 h内的毒性反应,若24 h内无死亡,则继续观察6 d,期间记录体重变化。第7 d处死小鼠,收集血样,测定血常规及血液生化指标。收集并记录各器官的重量,计算脏器指数。结果表明,给药后7 d内小鼠没有死亡。同时与空白组相比,给药组小鼠(雄性和雌性)均生长正常,没有观察到明显的毒性反应。在给药后的7 d时间里,小鼠的体重逐渐增加,没有观察到明显的异常行为及现象。同时与空白组相比,给药组小鼠的血液生化指标和脏器指数及血常规参数均无明显变化。因此,可以初步判定化合物HNW-002毒性较低。
HNW-002具有更低的系统暴露量,更高的结肠组织分布,更低的口服剂量 (1.5 mg/kg),以托法替尼(10 mg/kg)的十分之一的口服剂量实现了相近的药效。5-ASA-PABA-Diamine体系可成功实现结肠靶向药物释放,可有效解决剂量限制性毒性问题,HNW-002具有较高的临床应用价值。
五、结肠靶向给药的优势及应用范围
口服结肠靶向给药后,药物在上消化道不释放,在回盲部才开始释放出来,从而使药物在人体结直肠发挥局部或全身治疗作用。由于结肠部位条件温和,代谢酶少,蠕动相对缓慢,因而采用结肠靶向给药对于结直肠疾病的治疗具有如下几个优点:1) 避免药物在胃和小肠的吸收,降低由于药物在胃和小肠吸收引起的一系列不良反应;2) 提高药物在大肠的局部浓度,达到增加疗效、降低用药剂量和提高患者顺应性,使药物充分发挥局部治疗的作用;3)药物缓慢通过结肠并延长药物在结肠局部停留时间,从而提高治疗效果;8)治疗结肠疾病如溃疡性结肠炎、出血性结肠炎、Crohn症药物在病变区直接释放将更有效;9)治疗结肠直肠癌的靶向给药系统可以提高局部药物浓度,从而提高疗效,还可以减少化疗药物对胃肠道的刺激,减少由于胃肠道吸收所引起的全身性毒副作用。另外,结肠靶向给药对于需经大肠给药来治疗的疾病具有特殊的意义。普通制剂口服后,一般在到达结肠和直肠前药物就会被吸收或降解,而直肠给药栓剂或灌肠剂亦有许多不足,如灌肠剂不仅使用不便而且药物在结肠的分布不均匀,个体差异大,药物只限于在直肠和乙状结肠,到达不了横结肠和升结肠,而栓剂只能用于治疗直肠疾病或全身治疗,无法达到结肠靶向给药的目的。有些药物容易被胃酸破坏或者被胰酶代谢而失去治疗作用,而药物在结肠就不受这些影响。把这些药物制成结肠靶向给药系统可以增加其生物利用度。蛋白多肽类药物往往在上消化道中被酶降解使口服给药遇到很大困难,而大肠中蛋白水解酶含量很低, 把药物运送到大肠部释放可以解决酶屏障问题,而且发现多肽类药物在小肠末端的吸收性很好,结肠靶向给药系统有望解决多肽类药物的生理屏障问题。在夜间发作的哮喘、心绞痛、关节炎等疾病的治疗中,药物在结肠缓慢释放将发挥长效作用。杀肠虫药和结肠诊断试剂的结肠靶向释放可以减小剂量和副作用。
口服结肠靶向给药系统不仅使用方便,而且可使药物以较高浓度分布于整个结肠和直肠,对结直肠疾病的治疗极为有利。另外,口服结肠靶向给药系统的使用,可以将需要制成栓剂或灌肠剂直肠给药的药物制成口服药物,提高患者的依从性,增强疗效。因此,开发口服结肠靶向给药系统具有重要意义。
5-ASA-PABA-Diamine结肠靶向给药系统利用结肠部位的肠道菌群产生的偶氮还原酶作用,可以实现在结肠部位特异性地释放所负载的药物。该系统可用于上述需要结肠靶向给药的应用场景,已申请中国发明专利,应用前景广阔。
联系人:王绍杰
联系电话:13998853283
Contact
联系我们地址:沈阳市沈河区万柳塘路41号
联系人:董女士 13709882332 王先生 13998853283
电话:024-31682991
邮箱:sales-hinewy@hinewy.com
沈阳海诺威医药科技有限公司 (C)2021 网络支持 中国化工网 全球化工网 生意宝 网盛建站 著作权声明
备案号:辽ICP备12017171号-1  辽公网安备 21010302000796号
辽公网安备 21010302000796号